סוּפּר מודל
בגיל 43 פרופ' יסמין פישר משנה את פני הרפואה, באמצעות מודלים ממוחשבים של תהליכים ביולוגיים. התוכנות שהגתה ופיתחה "מחקות" מחלות ומספקות לחוקרים ולרופאים הבנה חסרת תקדים של סרטן. בראיון בלעדי למוסף כלכליסט מסבירה פישר איך המודלים האלה כבר מניבים טיפולים חדשניים, ואיך מות אביה מסרטן הוביל למשימת חייה: לנצח את המחלה
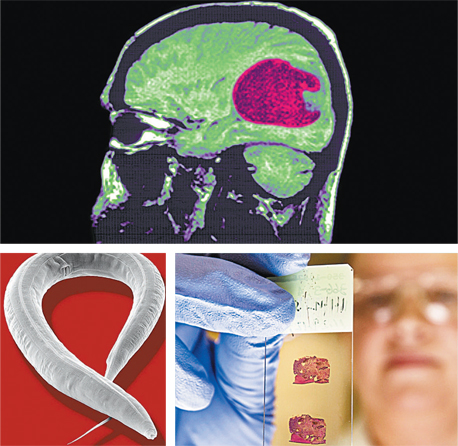
גליובלסטומה רב־צורנית — שם ארוך למחלה קשה ואכזרית. GBM הוא הסרטן האלים והממאיר ביותר שיכול להתפתח בראש. הוא פולש במהירות לרקמות המוח ומוביל באופן כמעט בלתי נמנע למות החולה ב־15 החודשים שלאחר האבחון. פחות מ־3% מהחולים שורדים חמש שנים. כ־40 אלף איש חולים בו בעולם בכל שנה, 450 מהם בישראל. אם אפשר, הם עוברים ניתוח שבו מוציאים את הגידול, ואחריו — כמו במקרים שבהם אי אפשר לנתח — הם מקבלים טיפולי קרינה וכימותרפיה, מותאמים ככל האפשר לגידול הייחודי ולהיסטוריה הרפואית שלהם. אבל קומבינציית הטיפול הזאת, כאמור, לרוב אינה מניבה תקופת הפוגה ארוכה ומאריכה את החיים רק במעט.
פרופ' יסמין פישר, ביולוגית שעובדת וחוקרת במעבדות מיקרוסופט ריסרץ' בקיימברידג' ובאוניברסיטת קיימברידג', מציעה לחולים האלה תקווה שנשמעת כמעט דמיונית: האונקולוג המטפל יזין לתוך תוכנת מחשב שהיא פיתחה את כל המידע על החולה ועל הגידול שלו. התוכנה תבנה את המודל הביולוגי הייחודי של הגידול שבמוחו, תצליב בינו לבין המודלים שמתארים התנהגות של תאים בריאים, תבין מה השתבש בגופו של החולה, ותמליץ על קומבינציית תרופות שמתאימה בדיוק לאדם הזה ולגידול הזה, עם מינימום תופעות לוואי. הסרטן ייהפך למחלה כרונית שחיים איתה בשליטה, לפרק זמן ארוך.
"אני אסביר לך איך אני חושבת על זה", אומרת פישר בראיון בלעדי ל"מוסף כלכליסט" וראשון לתקשורת הישראלית, "יש לנו תא שמתנהג באיזשהו אופן — מתחלק, מת, נע — ונשאלת השאלה מה התוכנית שרצה בתוך התא ואומרת לו איך להתנהג. מה שאני מנסה לעשות בחיים זה לכתוב את התוכנית הזאת, שמתארת את התנהגות התא הבריא, כתוכנת מחשב. ברגע שאת עושה את זה, ואת מסוגלת להגיד מה ההוראות המדויקות שאומרות לתא איך להתנהג כשהוא מתנהג באופן תקין, את גם מסוגלת לומר מה המתכון להתנהגות פחות רצויה (של תא חולה) ואיך אפשר לתקן אותה".

התוכנה של פישר בעצם יוצרת מודל ממוחשב של תהליך ביולוגי תקין, ואז משווה אותו לנתונים שמתקבלים מתצפיות במעבדה על תהליכים לא תקינים, אלה המתרחשים בזמן מחלה. ההשוואה מבהירה מה הפער בין הבריא למשובש, ומאפשרת להבין טוב יותר איפה השיבוש. מעבר לכך, התוכנה יכולה לבנות מודל של גידול ספציפי של חולה ספציפי - באמצעות שימוש בכל תוצאות הבדיקות שלו, מידע על תרופות שקיבל בעבר, נתונים גנטיים רלבנטיים, היסטוריה רפואית וכן הלאה — ועל המודל הזה "להפעיל" טיפול, למשל לדמות, באמצעות נתונים, טיפול כימותרפי או אחר. התוכנה תבדוק את התאמת הטיפולים השונים לגידול ולחולה הספציפיים, ובתוך דקות תבהיר מה הטיפול הכי אפקטיבי עבור החולה (ראו מסגרת).
כלומר התוכנה מחקה את ההתנהגות הלא רצויה של הגידול?
"בדיוק. ויש לנו מודל כזה בגידול GBM. בסרטן הזה יש שונות גדולה מאוד בין החולים ולכן הטיפול צריך להיות תפור לחולה. היום, במקרה הטוב, לוקחים ממנו ביופסיה, מגדלים תרבית, בודקים את השפעת התרופות עליה, ואחרי כמה שבועות או חודשים של ניסויים על התרבית רואים מה מתאים לחולה. אנחנו בונים מודל ממוחשב שעושה סימולציה של הגידול הספציפי של אותו חולה: הרופא מכניס את כל הנתונים של החולה, והתוכנה מחקה את ההשפעות של הכימותרפיה והקרינה כדי למצוא את הטיפול הכי יעיל עבור החולה".
נשמע קצת מדע בדיוני.
"פרנקנשטיין. אבא שלי נפטר לפני כמה שנים מסרטן ריאות, וכשהיו שואלים אותו מה הבת שלו עושה הוא היה אומר 'פרנקנשטיין'", היא משיבה ומשפילה עיניים, עד שגל ההתרגשות ששוטף אותה יחלוף. "זו גם הסיבה שבחרתי להתמקד בסרטן", היא אומרת לבסוף. "כנראה שהייתי בוחרת בנתיב אחר אלמלא אבא שלי ובני המשפחה האחרים והחברים שאיבדתי לסרטן לאורך השנים. זו מחלה שכל כך הרבה אנשים חולים בה ואני מקווה שאוכל לתת תקווה. הרגשתי שאי אפשר להמשיך בלי לעשות משהו, ואתה תמיד רוצה לתרום ולעשות משהו שאפשר לראות את האפקט שלו. אני באמת חושבת שבעשור הקרוב נראה את המהפכה הזאת".
אנשים לא ימותו מסרטן?
"התחזית האישית שלי היא שבעוד עשר שנים הסרטן יהיה בעיה פתורה. אני לא אומרת שאנשים לא יחלו בסרטן, אבל נהיה בשליטה עליו, יהיה אפשר לנהל אותו. ברגע שמגדירים את המנגנון של המחלה ואת התהליכים שגורמים לה, אפשר גם לשלוט בהם. זה כמו בבעיית תנועה: יש לך מפה כוללת, ואם יש פקק בכביש אחד אפשר לחשב את כל הכבישים והמעקפים האפשריים ולמצוא את הטוב ביותר".
לחשוב אחרת על גוף האדם
כשפישר מסבירה את זה, זה נשמע הגיוני לגמרי, אפילו מתבקש: לנסות להבין את תהליך התפתחות המחלה באמצעות כוחות החישוב האדירים שהטכנולוגיה מציעה היום, ואז להבין איך לטפל בה. אבל עד פישר, זה לא נעשה. וגם כשהיא הגתה את הרעיון, היא היתה צריכה לבנות אותו בעצמה, לבנה אחרי לבנה, בדרך לשינוי פוטנציאלי של הרפואה כולה. תוכנה ואלגוריתמים ומסלולים כמו בפקקים — ה־Waze של תאי הגוף, אם תרצו, יכול לסייע בטיפול לא רק בסרטן אלא גם במחלות נוספות כמו סוכרת ואסתמה.
המהפכה הזאת כבר בדרך. בעולם הביולוגיה והרפואה אמנם נדרש זמן כדי ששינויים גדולים יתורגמו מידע תיאורטי, מוצלח ומוכח ככל שיהיה, לכלים שניתן ליישם בבתי החולים ובמעבדות, אבל פישר ואנשיה כבר פיתחו כלים כאלה, שמצליחים להניב פתרונות פורצי דרך לסרטן. לפני כשנה המודל הממוחשב שפיתחה הציע קומבינציית תרופות חדשה ולא ידועה עד אז ללוקמיה מסוג CML, קומבינציה שנוסתה בהצלחה על תאים חולים במעבדה. המחקר הזה (שיפורט בהמשך) עורר עניין רב בחוגי הביולוגים, וחוקרים נוספים החלו לאמץ את השיטה של פישר כדי לחקור תהליכים ביולוגיים בלתי מפוצחים. עוד קודם למחקר הזה היתה פישר כוכבת עולה בעולם האקדמיה; היא מוזמנת להרצות באוניברסיטאות ובכנסים ברחבי העולם עשרות פעמים בשנה, המאמרים שפרסמה צוטטו יותר מ־1,500 פעמים והיא זוכה לסיקור מעריך בבמות מרכזיות כמו כתב העת "נייצ'ר".

יכול להיות שזו תחילת הסוף של הסרטן, ויכול להיות שאלה החומרים שמהם עשויים פרסי נובל. בינתיים, בדרך, פישר (43) מצוידת בתשוקה אמיתית, המון נחישות וגם מזל. היא נכנסה לתמונה ברגע הנכון, שבו עולם הביולוגיה ועולם המחשבים היו בשלים להשתלב, והצליחה להתברג למקומות הנכונים, בחזית שבה חוקרים ומפתחים את הקומבינציה בין ביולוגיה למחשבים כדי להבין טוב יותר איך הגוף שלנו עובד, ולעזור לו.
הפגישה איתה מתקיימת בישראל בסוף פברואר. היא הגיעה לכאן כדי להרצות באירוע Think Next של מרכז המו"פ של מיקרוסופט ישראל, שבו השתתף גם מנכ"ל החברה סאטיה נאדלה. כיום היא חיה בקיימברידג', אנגליה, עם בתה בת ה־14, אבל היא גדלה בקריית אונו עד גיל 9 ואז עברה עם משפחתה לערד בעקבות האסתמה שלה. כילדה חלמה להיות שחקנית, אבל כבר בתיכון המירה את הבמה במדע. בצבא שירתה בבית הספר לטיסה של חיל האוויר, לימדה פרחי טיס פיזיקה, ולאחר מכן נרשמה ללימודי רפואה באוניברסיטת בן־גוריון. אלא שכעבור שנה החליטה שהיא מתעניינת יותר במחקר קליני, והשלימה תואר ראשון במדעי החיים. בגלל הסקרנות והרצון לגוון, את התואר השני עשתה בביופיזיקה ופיזיולוגיה, ואת הדוקטורט בנוירו־אימונולוגיה, במכון ויצמן, שם התמקדה בקשר בין המערכת החיסונית למערכת עצבים מרכזית חבולה.
בסוף העבודה שלה על הדוקטורט, בראשית שנות האלפיים, החל להתבהר הפוטנציאל הגלום בקישור בין מערכות מלאכותיות ממוחשבות למערכות הטבעיות של גוף האדם. חוקרים משני התחומים החלו להבין עד כמה מחשבים יכולים לתרום להבנת קשרי הגומלין בין מערכות ביולוגיות (מה שמכונה ביולוגיה מערכתית, Systems Biology) ולניתוח ולארגון מידע ביולוגי רב ומורכב (ביואינפורמטיקה), והשימוש במחשבים לניתוח רצפי DNA וביטויי גנים (Gene Expression) המריא.
"מה שמשך אותי היה משהו אחר: אחרי שמדעני מחשב מפתחים תוכנה, יש טכניקות חישוביות אוטומטיות שמוודאות שהמערכת שהם בנו עושה מה שהם רצו שהיא תעשה (בשפה המקצועית זה נקרא אימות פורמלי, Formal Verification)", מספרת פישר. "ברגע שהבנתי את זה, החיבור היה מיידי. הבנתי שזה מה שאני רוצה כביולוגית ניסויית: שכשאני מסיימת את יום העבודה שלי ומציירת איזו סכמה שאמורה לתאר איך המערכת שלי עובדת לאור הנתונים שהפקתי במעבדה, אני רוצה לאמת את פיסת הביולוגיה הזאת — אבל לא עם הראש ועם עט ונייר, אלא בצורה אוטומטית".
למה עם מחשב ולא עם הראש?
"יש פה מורכבות עצומה שלא מאפשרת לנו לעשות את זה עם הראש. בתוך תא יש המון המון מסלולים שיובילו אותו מנקודת ההתחלה לאיזושהי התנהגות", היא אומרת ומשרטטת עם אצבעותיה באוויר גלים יורדים. "במערכות ביולוגיות יש מיליוני מולקולות, חלבונים, גנים, שכולם מתקשרים זה עם זה במקביל, והכל מתוזמר כדי שיתרחש בזמן הנכון ובמקום הנכון. התא יכול להפעיל מסלול אחד, מסלול שני, את שניהם; הוא יכול להפעיל אותם בזמנים שונים. יכולות להיות מיליוני אופציות להגיע מ־A ל־B, אבל את לא יכולה לבדוק את כל האופציות האלה, והכלים הממוחשבים כן".
אלא שהכלים הממוחשבים שהיו קיימים אז התאימו לעולם המחשבים, לא לביולוגיה. "הם נועדו לאמת תוכנות במטוסי F16 או מכוניות BMW, כלומר במערכות הנדסיות שהאדם יצר. אבל אנחנו לא יציר האדם, אנחנו תוצאה של אבולוציה. המערכות שלנו מתפתחות, מגיבות, ואין מהנדסת שאפשר להתקשר אליה ולבקש שתראה לי את התוכניות של המערכת". זו היתה המשימה הראשונה של פישר: לפתח את כלי התוכנה כך שיתאימו לביולוגיה. לזה היא הקדישה את הפוסט־דוקטורט שלה — שנה וחצי במעבדה של פרופ' דוד הראל במכון ויצמן, ועוד שלוש שנים עם פרופ' תומס הנזינגר, מדען מחשבים, שבאותם ימים עבד בבית הספר הפוליטכני הפדרלי (EPFL) בלוצרן, שוויץ. שם היא פיתחה שפה חדשה בביולוגיה, שמאפשרת גם התקדמות מפתיעה בחקר הסרטן.

ענף שמשנה את פני הביולוגיה
C. elegans, נמטודה בעברית, היא תולעת באורך מילימטר בלבד שחיה בחול. חוקרים אוהבים אותה כי היא פשוטה — מתחילה בתא אחד ומסיימת בכאלף תאים —
ושקופה, כך שאפשר לראות את כל תהליך ההתפתחות של כל איבריה תחת עדשת המיקרוסקופ. לכן ההתפתחות של הנמטודה מתועדת לגמרי, מקצה לקצה. ולתיעוד הזה יש חשיבות גדולה, משום שבני האדם והנמטודות חולקים אותם מסלולים של סרטן בתא. כשפישר רצתה לבדוק את כלי המידול והאימות הממוחשבים שפיתחה, הנמטודה היתה שם לסייע לה בכך.
בשלב הראשון היא הזינה למחשב, בשפת תכנות פורמלית, את כל המידע המחקרי שקיים על התפתחות מערכת הטלת הביצים של הנמטודה ברמת התאים. כאשר הזינה למחשב את האותות השונים שמשפיעים על התפתחות התאים כך שיפעלו באופן מסונכרן, המודל לא הצליח לחקות את הביולוגיה האמיתית של התפתחות מערכת הטלת הביצים. כשניסתה להזין אותם באופן א־סינכרוני לחלוטין המודל נכשל שוב. אבל ברגע שניסתה תזמון ביניים, שבו האותות אינם מסונכרנים אבל עדיין די סמוכים, זה הצליח. כך היא גילתה מנגנון מולקולרי שבאמצעותו התאים מסנכרנים את ההתנהגות שלהם.
"ברגע שיישמנו את הפתרון הזה הדברים התנהגו כמו שצריך ושחזרו את התפתחות מערכת הטלת הביצים, וזה היה סוּפּר מעניין", מספרת פישר בגאווה. בשלב הבא, פישר וחוקר שמתמחה בנמטודות חקרו את התאים של התולעת במעבדה, והצליחו למצוא את המנגנון שמאפשר את חוסר הסנכרון המוגבל הזה.
כך, מלבד הגילוי עצמו, פישר הוכיחה שהשיטה המהפכנית שהיא פיתחה עובדת: היא הצליחה לפתח כלי מחשב שבונים מודל של התנהגות ביולוגית. בדרך היא זיהתה מנגנון ביולוגי לא מוכר שלהערכתה תורם לעוד מערכות בגוף, ואז היא אימתה את הגילוי הזה במעבדה, על תאים אמיתיים. "זה משהו שבחיים לא היינו עולים עליו, זה אדיר".

הממצאים של פישר עוררו עניין רב, והנזינגר, המנחה משוויץ, דחק בה לתת שם לדבר הזה שהיא עושה, תחת המטרייה של ביולוגיה מערכתית. כך טבעה פישר את המושג Executable Biology, שאנחנו מתקשות לתרגם לעברית באופן שיהלום את הכוונה: נסתפק ב"ביולוגיה בהרצת מחשב", תהליכים ביולוגיים שניתן להריץ ולבדוק באמצעות מחשב במהירות וביעילות, בשברירי זמן ועלות לעומת מה שהיה נדרש לו היו נבדקים במעבדה. המאמר שפישר והנזינגר פרסמו ב־2007, שבו הציגו את ה־Executable Biology, צוטט עד היום יותר מ־400 פעמים, והתחום החדש הסעיר את החוקרים.
כי השיטה הזאת משנה את האופן שבו ביולוגים עובדים. קודם הם עבדו עם משוואות מתמטיות, מה שחייב אותם לדעת מה הערך המספרי של כל משתנה במשוואה. בתוכנות של פישר, לעומת זאת, אפשר להזין למודל משתנים איכותיים — למשל, "התא הזה הוא הקרוב ביותר לתא ששולח את האותות, אז המולקולות, שהן השליח, מגיעות אליו קודם", בעוד במודלים מתמטיים המידע הזה היה אמור להיות מדויק, נושא ערך מספרי. "חשבו שאני משוגעת, אבל לא תמיד יש לנו נתונים כמותיים, לפעמים כל מה שיש לנו זה רק הבנה איכותית, וזו היתה פחות או יותר הרמה שבה תמיד התעסקתי, גם בדוקטורט שלי. אבל אם את חוזה משהו באמצעות המודל ומשתנים איכותיים, ואז הולכת למעבדה ומוכיחה אותו — יש לזה אישור", היא אומרת.
אחרי שלוש שנים במעבדה בשוויץ פנה אליה עמית ממיקרוסופט ריסרץ' בקיימברידג' — אחד מ־11 מרכזי המחקר של חברת מיקרוסופט בעולם, שמעסיקים יותר מאלף חוקרים בעבודה שנוגעת בעיקר לטכנולוגיות מחשבים אך גם לבריאות, רווחה, חינוך וכלכלה. אותו עמית סיפר לפישר שמקימים שם קבוצת מחקר שעוסקת בדיוק בנושאים שמעניינים אותה והציע לה להצטרף. מאז היא בקיימברידג', חובשת שני כובעים מכובדים מאוד: בראשון היא מובילה קבוצת מחקר של מיקרוסופט שעוסקת בעקרונות וכלי תכנון, בשני היא פרופסורית במחלקה לביוכימיה באוניברסיטת קיימברידג' וחברה בכמה ארגונים מקצועיים באוניברסיטה כמו מרכז הסרטן, מרכז הביולוגיה המערכתית ומוסד תאי הגזע. היא עובדת עם כ־15 חוקרים, ביולוגים ומדעני מחשב, חלק מהם סטודנטים מהאוניברסיטה לתארים מתקדמים שמעדיפים לעבוד איתה ועם הצוות שלה במיקרוסופט.

ואז התוכנה הציעה טיפול חדשני
כעת, כשהכלים החדשניים שפיתחה עובדים, פישר עוסקת בהפצה שלהם כדי שיסייעו לרופאים ולביולוגים כמוה, ובביצוע מחקרים שיעזרו לאנשים לחיות חיים בריאים יותר. היא מתמקדת בסרטן, כנראה האתגר הגדול ביותר של הרפואה בעשורים האחרונים, כי "לסרטן אין מטרה, תוכנית או פונקציה", כפי שהסבירה בהרצאה שנשאה בארץ. "הוא פשוט מתפתח ומתקשר עם הגנטיקה שלנו ועם הסביבה, בלי תוכנית בהירה, ולכן כל כך מורכב לטפל בו".
בפברואר 2015 הגיעו פישר ועמיתיה לגילוי פורץ דרך: הם בנו מודל ממוחשב של תאי לוקמיה, והגיעו באמצעות תוכנת מחשב לקומבינציית תרופות שלא היתה מוכרת עד אז ונמצאה אפקטיבית ביותר לטיפול בלוקמיה מסוג CML (Chronic Myeloid Leukemia). "בנינו מודל של תאי לוקמיה, עם האינטראקציות בין המסלולים השונים שמדברים זה עם זה ועם הביטוי המוגבר של גן שמתבטא רק בתאים לוקמיים, ואז בדקנו על המודל קומבינציות של תרופות, כדי למקסם את האפקט החיובי שלהן בכמה שפחות תופעות לוואי", היא מסבירה. "כך חזינו שקומבינציית תרופות שלא היתה ידועה קודם יכולה לעשות את זה, ובאמצעות המודלים גם חזינו איך אפשר לעקוף את העמידות לתרופות שהגוף מפתח".
בשיתוף פעולה עם חברת התרופות אסטרה־זנקה נוסתה קומבינציית התרופות על דגימות שנלקחו מחולי לוקמיה — והניבוי התאמת; בשלב זה, מאחר שהמאמר עוד לא פורסם, היא לא יכולה למסור נתונים מדויקים, אולם לדבריה תוצאות הניסוי מעודדות. "זה מאוד מרגש, כי עם המודלים האלה אפשר לתפור את הפתרון המתאים לכל חולה, על הגנטיקה, המוטציות ותופעות הלוואי שייחודיות לו. זה אדיר".
כעת הצוות שלה בונה מודל של Myc, גן מפתח בכמה סוגי סרטן ברקמות שונות, כמו מלנומה וסרטן שד, כדי למצוא להם פתרון. נוסף על כך הם בונים מודלים של התפתחות תאי הדם, שכאשר אינה תקינה היא הבסיס לרוב מקרי הלוקמיה. כלי התוכנה שעשויים לשמש אונקולוגים וביולוגים בקבלת החלטות טיפוליות, כמו במחקר המוצלח על GBM, זמינים לרופאים ולחוקרים בענן של מיקרוסופט, שפועלת להפוך אותם כעת למוצר שיהיה נגיש בבתי חולים ובמעבדות.
היום תרופות אימונותרפיות לסרטן מעוררות תקווה רבה. הכלים שפיתחת מתאימים להן?
"הדברים משתלבים. גם באימונותרפיה צריך להבין את המנגנונים של המחלה, ובגישה שלי הלב הוא להבין את המכניזם, את המנגנונים והמניעים. בסופו של דבר הכל יעבוד יחד".
אנחנו מדברות על תרופות ועל להציל אנשים, אבל היום התרופות כל כך יקרות ויש אנשים שלא יכולים להרשות לעצמם לקנות אותן.
"אלה עניינים פיננסיים שאני לא יכולה לפתור, אבל מה שהשיטות האלה יכולות להציע זה חיסכון של הרבה מאוד זמן וכסף בשלב פיתוח התרופה והניסויים, כי המודל מדמה בזמן קצר ניסויים שיכולים לקחת שבועות במעבדה. לאן חברות התרופות ייקחו את זה משם אני לא יודעת, אבל אני חושבת שהיום הן מחפשות טכנולוגיות שיהפכו את פיתוח התרופות ליותר יעיל וזול. אני רוצה לעזור לאנשים ולפתור בעיה, וארגיש סיפוק כשאראה שהשיטות האלה הן חלק מהמחקר היומיומי בכל מעבדה ובקליניקה".
כדי שזה יקרה, הטכנולוגיה של פישר ידידותית גם למי שאינו מתכנת מחשב, כך שכל ביולוג ואונקולוג יוכלו להשתמש בתוכנות בקלות. הן מבוססות על כלי drag and drop, תצוגה ויזואלית מוחשית, ובעתיד התוכנות יגזרו את הנתונים שנאספים במעבדה וייצרו באופן אוטומטי את המודל.
בעתיד הרחוק יותר, פישר מאמינה שהטרמינולוגיה ביחס לסרטן תשתנה: הוא לא ייקרא על שם האיבר שבו יש גידול, אלא על שם המסלול המסוים בתא שבו חלה תקלה. "אני חושבת שבאמצעות הגישה הזאת נפסיק לדבר על סרטן לבלב וסרטן ריאות, ונדבר על המסלולים שבהם התא קיבל החלטה שגויה (למשל כשתאים מתחילים להתחלק ללא צורך, באופן בלתי נשלט) — ובעזרת המודל הממוחשב נמצא תרופה או קומבינציית תרופות שמתאימה למסלול הזה. המקומות האלה, שבהם התא קיבל החלטה שגויה, משותפים להרבה מחלות, והדרך היחידה לתפוס אותם היא להריץ את כל הקומבינציות האפשריות ולהתחקות אחרי מנגנון המחלה והגורמים שמקדמים אותה. ברגע שמבינים את המנגנון ויודעים איך לשלוט בו, הבעיה פתורה. וזה נכון כמובן לא רק לסרטן, כל מחלה אפשר לתאר בצורה מכניסטית".
עוד עשר שנים, אם הסרטן יהיה באמת בעיה פתורה, במה תעסקי?
"נדבר אז. זה כל היופי במדע, שהוא מתפתח ושאין יום שדומה ליום הקודם. כל הזמן דברים מתקדמים וככל שאת עושה יותר יש לך יותר דברים לעשות. זה עולם מרתק, והשמים הם הגבול".





